Электромеханическое сопряжение в мышцах. Строение скелетных мышц
Электромеханическое сопряжение - это цикл последовательных процессов, начинающийся с возникновения потенциала действия ПД на сарколемме (клеточной мембране) и заканчивающийся сократительным ответом мышцы.
Нарушение последовательности процессов сопряжения может приводить к патологиям и даже к летальному исходу.
Процесс сокращения кардиомиоцита происходит в следующем порядке:
1) при подаче на клетку стимулирующего импульса открываются быстрые (время активации 2 мс) натриевые каналы, ионы Na + входят в клетку, вызывая деполяризацию мембраны;
2) в результате деполяризация мембраны открываются потенциал-зависимые медленные кальциевые каналы (время жизни 200 мс), и ионы Са 2+ поступают из внеклеточной среды, где их концентрация ≈ 2 ∙10 3 моль / л, внутрь клетки (внутриклеточная концентрация Са 2+ ≈10-7 моль / л);
3) кальций, поступающий в клетку, активирует мембрану СР, являющегося внутриклеточным депо ионов Са 2+ (в СР их концентрация достигает более 10 -3 моль/л), и высвобождают кальций из пузырьков СР. В результате возникает так называемый «кальциевый залп». Ионы Са 2+ из СР поступают на актин-миозиновый комплекс саркомера, открывают активные центры актиновых цепей, вызывая замыкание мостиков и дальнейшее развитие силы и укорочения саркомера;
4) по окончании процесса сокращения миофибрилл ионы Са 2+ с помощью кальциевых насосов, находящихся в мембране СР, активно закачиваются внутрь саркоплазматического ретикулума;
5) процесс электромеханического сопряжения заканчивается тем, что ионы Na + и Са 2+ - активно выводятся во внеклеточную среду с помощью соответствующих ионных насосов.
Пассивные потоки 1,2 и 3 обеспечивают процесс сокращения мышцы, а активные потоки 4 и 5 - ее расслабление.
Таким образом, в кардиомиоците электромеханическое сопряжение идет в две ступени: вначале небольшой входящий поток кальция активирует мембраны СР, способствуя большему выбросу кальция из внутриклеточного депо, а затем в результате этого выброса происходит сокращение саркомера. Заметим, что описанный выше двухступенчатый процесс сопряжения доказан экспериментально.
Опыты показали, что: а) отсутствие потока кальция извне клетки I прекращает сокращение саркомеров, б) в условиях постоянства количества кальция, высвобождаемого из СР, изменения амплитуды потока приводит к хорошо коррелирующему изменению силы сокращения. Поток ионов Са 2+ внутрь клетки выполняет, таким образом, две функции: формирует длительное (200 мс) плато потенциала действия кардиомиоцита и участвует в процессе электромеханического сопряжения.
3. Цель деятельности студентов на занятии:
Студент должен знать:
1.Структуру мышцы.
2.Основные положения модели скользящих нитей.
3.Трехкомпонентную модель Хилла.
4.Изометрический и изотонический режимы исследования характеристик сокращающихся мышц.
5.Механизм электромеханического сопряжения в мышцах.
Студент должен уметь:
1. Объяснять модель скользящих нитей.
2. Объяснять трехкомпонентную модель Хилла.
3. Анализировать уравнение Хилла.
4. Объяснять процесс сокращения кардиомицита.
5. Решать ситуационные задачи по данной теме.
1. Структура мышцы. Саркомер.
2. Модель скользящих нитей.
3. Пассивное растяжение мышцы. Трехкомпонентная модель Хилла.
4. Активное сокращение мышцы.
5. Уравнение Хилла.
6. Мощность одиночного сокращения.
7. Электромеханическое сопряжение.
8. Решение ситуационных задач.
5. Перечень вопросов для проверки исходного уровня знаний:
1. Что является элементарной сократительной единицей мышечной ткани?
2. Опишите микроструктуру саркомера.
3. Что является механохимическим преобразователем энергии АТФ?
4. Как осуществляется процесс укорочения и генерации силы в саркомере? Каковы основные положения модели скользящих нитей?
5. Почему для исследования процесса сокращения мышцы приходиться разделять режимы ее работы на изотонический и изометрический? Какой режим реализуется в реальных условиях сокращения?
6.Что понимают под электромеханическим сопряжением? Какие фазы электромеханического сопряжения в кардиомиоците и в скелетной мышце осуществляются пассивными потоками ионов, а какие активными?
6. Перечень вопросов для проверки конечного уровня знаний:
1. Охарактеризуйте трехкомпонентную модель Хилла.
2. Объясните механизм активного сокращения мышцы.
3. Почему при различных начальных длинах мышцы изометрическое сокращение имеет различную форму зависимости F(t)?
4. Можно ли по кривой зависимости V(Р) Хилла (рис. 7) определить, какой максимальный груз может удерживать мышца?
5. Опишите процесс сокращения кардиомицита.
7.Решите задачи:
1.Сухожилие длиной 16 см под действием силы 12,4 Н удлиняется на 3,3 мм. Сухожилие можно считать круглым в сечении с диаметром 8,6 мм. Рассчитайте модуль упругости этого сухожилия.
2.Площадь сечения бедренной кости человека равна 3 см 2 . Какую силу сжатия может выдержать кость, не разрушаясь?
3.Для определения механических свойств костной ткани была взятапластинка из свода черепа со следующими размерами: длина L = 5 см, ширина b = 1 см, толщина h = 0,5 см. Под действием силы F = 200 Н пластинка удлинилась на ∆L = 1,2∙10 -3 см. Определите по этим данным модуль Юнга костной ткани при деформации растяжения.
4.Из большеберцовой кости собаки вырезали стержень прямоугольного сечения с ребрами а = 2 мм, b = 5 мм. Стержень положили на упоры, находящиеся на расстоянии L = 5 см друг от друга, и посередине между ними к нему приложили силу 28 Н. При этом стрела прогиба оказалась равной 1,5 мм. Определите модуль Юнга для этой кости.
8. Самостоятельная работа студентов:
По учебнику Антонова В.Ф. и др. (§§ 20.4.) изучите временное соотношение между потенциалом действия кардиомицита и одиночным сокращением.
9. Хронокарта учебного занятия:
1. Организационный момент – 5 мин.
2. Разбор темы – 30 мин.
3. Решение ситуационных задач – 60 мин.
4. Текущий контроль знаний – 30 мин
5. Подведение итогов занятия – 10 мин.
10. Перечень учебной литературы к занятию:
1.Ремизов А.Н. Максина А.Г., Потапенко А.Я. Медицинская и биологическая физика. М., «Дрофа», 2008, §§ 8.3, 8.4.
Связь между возбуждением и сокращением мышечного волокна описана А.Хаксли (1959). Осуществляется при помощи системы поперечных трубочек поверхностной мембраны (Т-системы) и внутриволоконного саркоплазматического ретикулума. Деполяризация, вызываемая потенциалом действия, распространяется на Т - систему и стимулирует освобождение ионов кальция из полостей ретикулума. Взаимодействие ионов кальция с регуляторным белком тропонином С приводит к активации системы сократительных белков актина и миозина. Механизм генерации потенциала действия принципиально не отличается от этого процесса в нейроне. Скорость его распространения по мембране мышечного волокна 3 - 5 м/c.
5. Режимы и виды сокращения мышц
Режимы сокращения мышцы: изотонический (когда мышца укорачивается при неизменном внутреннем напряжении, например, при нулевой массе поднимаемого груза) и изометрический (при этом режиме мышца не укорачивается, а лишь развивает внутреннее напряжение, что бывает при нагрузке неподъёмным грузом). Ауксотонический режим - при сокращении мышцы с нагрузкой вначале в мышце возрастает напряжение без укорочения (изометрический режим), затем, когда напряжение преодолевает массу поднимаемого груза, укорочение мышцы происходит без дальнейшего роста напряжения (изотонический режим).
Различают виды сокращений: одиночное и тетаническое. Одиночное сокращение возникает при действии на мышцу одиночного нервного импульса или однократного толчка тока. В миоплазме мышцы происходит кратковременный подъём концентрации кальция, сопровождаемый кратковременной работой - тягой миозиновых мостиков, сменяющейся покоем. В изометрическом режиме одиночное напряжение начинается через 2 мс после развития потенциала действия, причём напряжению предшествует кратковременное и незначительное латентное расслабление.
Тетанус - это сложное сокращение, возникающее при стимуляции с частотой выше, чем длительность одиночного мышечного сокращения. Тетанус бывает зубчатый, если мышца совершает незначительные колебания на высоте амплитуды сокращения, и гладкий - при постоянном во времени сокращении. При относительно малой частоте раздражений возникает зубчатый тетанус, при большой частоте - гладкий тетанус. Чем быстрее сокращаются и расслабляются волокна мышцы, тем чаще должны быть раздражения, чтобы вызвать тетанус.
В естественных условиях мышечные волокна работают в режиме одиночного сокращения только тогда, когда длительность интервала между разрядами мотонейронов равна или превышает длительность одиночного сокращения иннервируемых данным мотонейроном мышечных волокон. В режиме одиночного сокращения мышца способна работать длительное время без утомления, совершая при этом минимальную работу. При увеличении частоты разрядов развивается тетаническое сокращение. При зубчатом тетанусе происходит непрерывное нарастание силы сокращения и выполняемой работы. Во время гладкого тетануса мышечное напряжение не изменяется, а поддерживается на достигнутом уровне. В таком режиме мышца человека работает при развитии максимальных изометрических усилий. Работа мышцы (А) измеряется произведением массы груза (Р) и расстояния (H), на которое этот груз перемещается.
Работа может быть динамической (преобладают изотонические режимы сокращения) или статической. Она может быть преодолевающей и уступающей.
Расслабление мышцы.
Восстановление потенциала покоя мембраны прекращает поступление из саркоплазматического ретикулума ионов кальция и дальнейший сократительный процесс. Кальций в миоплазме активирует Са-АТФ-азу, кальциевый насос осуществляет активный перенос этого иона в саркоплазматический ретикулум. Возврат мышцы в исходное, растянутое положение определяется массой костей скелета, связанных с данными мышцами и создающими растягивающее усилие после прекращения процесса сокращения. Вторым моментом является упругость мышцы, которая преодолевается в момент сокращения. Структурной основой упругости мышцы являются:
Поперечные мостики.
Участки прикрепления концов миофибрилл к сухожильным элементам мышечного волокна.
Наружные соединительнотканные элементы мышцы и её волокна.
Места прикрепления мышц к костям.
Продольная система саркоплазматического ретикулума.
Сарколемма мышечного волокна.
Капиллярная сосудистая сеть мышцы.
Соотношение между временным ходом потенциала действия в мышечном волокне и возникающим в результате этого сокращением мышечного волокна с последующим его расслаблением.
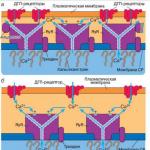
Электромеханическое сопряжение
Это последовательность процессов, в результате которых потенциал действия плазматической мембраны мышечного волокна приводит к запуску сокращения мышцы или к так называемому циклу поперечных мостиков, который будет продемонстрирован далее.
Плазматическая мембрана скелетных мышц электрически возбудима и способна генерировать распространяющийся потенциал действия посредством механизма, аналогичного тому, который действует в нервных клетках. Потенциал действия в волокне скелетной мышцы длится 1-2 мс и заканчивается раньше, чем появятся какие-либо признаки механической активности (рис. 12 ). Начавшаяся механическая активность может продолжаться более 100 мс. Электрическая активность плазматической мембраны не оказывает прямого влияния на сократительные белки, а вызывает повышение цитоплазматической концентрации ионов Са 2+ , которые продолжают активировать сократительный аппарат и после прекращения электрического процесса.
Что представляет собой сопряжение возбуждения и сокращения (ВС сопряжение)?
Запуск нервным импульсом сокращения скелетной мышцы. При нормальных условиях скелетная мышца в покое слегка натянута. Это свидетельство минимального или слабого связывания актина с миозином. Нервный импульс, достигший терминального нервного окончания, передается на ацетилхолиновый рецептор. В скелетной мышце этот рецептор представлен специализированным образованием, которое называется двигательной концевой пластинкой. Двигательная концевая пластинка представляет собой участок сарколеммы с множеством складок, расположенный в непосредственной близости от нервного окончания. Выделенный нервным окончанием ацетилхолин диффундирует через синаптическую щель и связывается с рецепторами, расположенными на многочисленных складках постсинаптической мембраны (концевой пластинки сарколеммы). Лиганд-рецепторное взаимодействие повышает проницаемость мембраны для натрия, что вызывает местную деполяризацию (потенциал действия концевой пластинки). Потенциал действия концевой пластинки распространяется по сарколемме в разных направлениях и проводится по Т-тру-бочкам внутрь мышечного волокна. Деполяризация триады (концевая цистерна, Т-трубочка и СР) вызывает высвобождение во внутриклеточную жидкость депонированных в СР ионов кальция. При наличии высокой концентрации ионов кальция и достаточного количества энергии запускается цикл поперечных мостиков. Гидролиз вновь синтезированных молекул АТФ реактивирует миозиновые головки, которые присоединяются к другим активным участкам молекулы миозина. Циклическая работа поперечных мостиков продолжается до тех пор, пока имеются свободные ионы кальция и достаточное количество АТФ.
Рис.13. Модель скользящих нитей.
Что такое теория скользящих нитей?
Эта теория объясняет, каким образом фиксированные толстые и тонкие филаменты перемещаются друг относительно друга и обеспечивают сокращение саркомера. Перемещение, происходящее во время цикла поперечных мостиков, обусловлено скольжением молекулы актина по миозину. Повторяющееся присоединение и отделение ряда поперечных мостиков приводит к тому, что параллельно расположенные филаменты скользят друг по другу, сокращая тем самым расстояние между двумя соседними г-линиями. Таким образом саркомер укорачивается. Сокращение саркомера приводит к возникновению некоторой силы.
Модель скользящих нитей
Во время генерирования силы, укорачивающей мышечное волокно, перекрывающиеся толстые и тонкие филаменты каждого саркомера, подтягиваемые движениями поперечных мостиков, сдвигаются друг относительно друга. Длина толстых и тонких филаментов при укорочении саркомера не изменяется (рис. 13 ). Этот механизм мышечного сокращения известен как модель скользящих нитей.
ПодробностиОсобенностью электромеханического сопряжения в сердечной мышце является то, что при возбуждении миокарда ионы кальция поступают в саркоплазму не только из цистерн саркоплазматического ретикулума, но также из Т-трубоче к. Без этого дополнительного источника ионов кальция сокращение сердечной мышцы было бы недостаточно сильным. Дело в том, что в отличие от скелетной мышцы саркоплазматический ретикулум в кардиомиоцитах развит слабее .
Что касается системы Т-трубочек, то они являются мощным депо кальция . Их диаметр в 5 раз, а объем жидкости в них в 25 раз больше, чем в волокнах скелетных мышц. Кроме того, в Т-трубочках имеется большое количество мукополисахаридов , несущих на поверхности отрицательный заряд. Связываясь с ионами кальция, они создают значительный запас этих ионов, способных немедленно диффундировать в саркоплазму при возбуждении.
Сила сокращения кардиомиоцитов зависит от внеклеточного кальция, а скелетных мышц - нет.
В отличие от скелетных мышц сила сокращения миокарда в значительной степени зависит от концентрации кальция во внеклеточной жидкости . Дело в том, что хорошо развитая система Т-трубочек, открываясь в окружающее внеклеточное пространство, заполнена внеклеточной (интерстициальной) жидкостью с высоким содержанием кальция. Таким образом, внеклеточная жидкость проникает глубоко внутрь волокон по системе Т-трубочек и служит необходимым источником ионов кальция для развития мышечного сокращения.
Сила сокращения скелетных мышц практически не зависит от изменений концентрации кальция во внеклеточной жидкости . Сокращение скелетных мышц полностью обеспечивается ионами кальция, поступающими в саркоплазму из цистерн саркоплазматического ретикулума, т.е. из внутриклеточных источников.
В конце фазы плато потенциала действия вход ионов кальция в кардиомиоцит прекращается. Из саркоплазмы ионы кальция быстро удаляются как обратно в саркоплазматический ретикулум, так и во внеклеточную жидкость Т-трубочек. В результате цикл сокращения в миокарде завершается вплоть до поступления нового потенциала действия.
Длительность сокращения скелетных и сердечных мышц.
Сокращение сердечной мышцы начинается через несколько миллисекунд после начала потенциала действия и заканчивается через несколько миллисекунд после завершения потенциала действия. Таким образом, длительность сокращения миокарда зависит от длительности потенциала действия , включая фазу плато, и составляет 0,2 сек в миокарде предсердий и 0,3 сек в миокарде желудочков.
Рианодиновый рецептор (RyR).
Рианодиновый рецептор (RyR) в мышечных клетках выполняет важнейшую функцию сопряжения потенциала действия с мышечным сокращением . В скелетных мышцах рианодиновые рецепторы активируются посредством специализированного механизма прямого электромеханического сопряжения , а сокращение сердечной мышцы запускается по механизму Са2+-индуцированного выброса Са2+ .

Обнаружено три изоформы рианодинового рецептора: RyR1 , RyR2 , RyR3 , кодируемые тремя разными генами. RyR имеют несколько мест регуляции, которая осуществляется Са2+ , АТР, кальмодулином (КМ) , иммунофилином и кальцинеурином. Рецептор фосфорилируется CaKMPK II (CaKM-зависимая протеинкиназа II) и дефосфорилируется кальцинеурином. В скелетных мышцах RyR1 расположен на цистернах СР примыкающих к цитоплазматической мембране и его длинный цитоплазматический "хвост" (так называемый "foot"-регион, или "ножка") соприкасается с дигидроперидиновым рецептором (DHPR) на плазмалемме . Однако, непосредственное функциональное взаимодействия между RyR и DHPR на молекулярном уровне еще не показано. Обсуждается вопрос об участии третьего белка в образовании контакта между RyR и DHPR.
Согласно разным структурным моделям С-конец RyR содержит от до 10 (12) трансмембранных доменов, формирующих мембранную пору. Активность RyR модулируется растительным алкалоидом рианодином из коры Ryania speciosa, что и определило его название. На каналы изолированные из мышц позвоночных и ракообразных рианодин в концентрациях от нМ до мкМ оказывает активирующее влияние, тогда как в концентрациях выше 100 мкМ он вызывает полное закрывание каналов. Было постулировано, что рианодин связывается с каналом в открытом состоянии. Физиологическим активатором рианодинового рецептора, в частности его сердечной изоформы и рианодин-чувствительного Ca2+- канала яйцеклеток морских ежей является циклическая АДР-рибоза (сADPR) - наиболее мощный из известных Са2+-высвобождающих агентов. Полумаксимальное высвобождение Са2+ в гомогенатах яйцеклеток морских ежей наблюдается при наномолярных концентрациях сADPR, что на порядок ниже, чем для IP3. Крутая зависимость активности RR от концентрации Са2+ (см рис. 6.8) позволяет говорить о механизме выброса Са2+ в присутствии cADPR как о Са2+-индуцированном выходе Са2+.
CaКM-зависимая протеинкиназа
фосфорилирует все три изоформы рецептора, что приводит к его активации
. Показано, что PKA и GMP-зависимая протеинкиназа также способны фосфорилировать этот же сайт. Фосфорилирование этого сайта cAMP-зависимой протеинкиназой, в частности при стимуляции b-адренорецептора, активирует сердечную изоформу RyR.
Генерация Са2+-сигнала с участием cADPR, в настоящее время показана для ряда тканей и клеток, для млекопитающих и растений. У млекопитающих активация секреции везикул ацинарными клетками поджелудочной железы и секреции инсулина b-клетками весьма чувствительны к подъему Са2+, вызванному именно этим циклическим нуклеотидом.

Краткое резюме по рианодиновым рецепторам:
Рианодиновые рецепторы(RyR) представляют собой особый тип хемоактивируемых Са2+каналов, имеющихся в мембране СР. Для млекопитающих известны 3 изоформы:RyR1,RyR2,RyR3. Нокаут гена:RyR1иRyR2–смерть в период эмбрионал разв-я.RyR3–жизнеспос-ые живот; значит-ое сниж-е CICR .Для скел м-ц:бол-во RyR1 спарены с DHPR. Более значит-ым оказыв мех-м DICR.Для сердеч м-цы:тока один из 5-10 RyR2 спарен с DHPR. Большее знач играет мех-зм CICR. Работы Фабиато: Суть: Налич отриц-ой обр-ой св, представлен Ca2+-зависимой инактив-ей RyR. Мех-м: Активацион сайт хар-ся выс акт-ью и низк сродством. Инактив-ый сайт хар-тся низкой акт-ью и выс сродством. Повыш-е конц-ции Ca2+ прив-ит к повыш-ю сродства к агонистам у RyR. Опыты с трипсином подтверд сущест-ие как полож-ой так и отриц-ой регул. Мех-мы взаимод-я: Прямое,с участками внутрен доменов RyR.Ч/з белки-посредники. Действие на наруж участки RyR. В сост RyR входит от 80 до 100 остат цистеина, мн из кот м.б.подвергнуты модиф-ции. Дей-е ок-ей: Подав-е функц-ой акт-ти. Сниж-е способ-ти к регул другими факторами. Модификация с пом NO:В мал конц-ях–повыш актив-ть RyR. В выс-их–понижает акт-ть RyR.
Электромеханическое сопряжение — это цикл последовательных процессов, начинающийся с возникновения потенциала действия ПД на сарколемме (клеточной мембране) и заканчивающийся сократительным ответом мышцы.
Нарушение последовательности процессов сопряжения может приводить к патологиям и даже к летальному исходу. Основные этапы этого процесса можно проследить по схеме рис. 7.11.

Рис. 7.11.
Схема электромеханического сопряжения в кардиомиоците (М — клеточная мембрана-сарколемма, СР — саркоплазматический ретикулум, МФ …
— миофибрилла, Z — z-диски, Т — Т-система поперечных трубочек); 1 — поступления Na + и 2 — поступления Са 2+ в клетку при возбуждении мембраны, 3 — "кальциевый залп", 4 — активный транспорт Са 2+ в СР, 5 — выход из клетки К + , вызывающий реполяризацию мембраны, 6 — активный транспорт Са 2+ из клетки
Процесс сокращения кардиомиоцита происходит следующим образом
1 — при подаче на клетку стимулирующего импульса открываются быстрые (время активации 2 мс) натриевые каналы ионы Na+ входят в клетку, вызывая деполяризацию мембраны
2 — в результате деполяризация плазматической мембраны в ней и в Т-трубочках открываются потенциал-зависимые; медленные кальциевые каналы (время жизни 200 мс), и ионы Са 2+ поступают из внеклеточной среды, где их концентрация ≈ 2 10 -3 моль / л, внутрь клетки (внутриклеточная концентрация Са 2+ ≈ 10 -7 моль / л);
3 — кальций, поступающий в клетку, активирует мембрану СР, являющегося внутриклеточным депо ионов Са 2+ (в СР их концентрация достигает ≈ 10 -3 моль / л), и высвобождает кальций из пузырьков СР, в результате чего возникает так называемый "кальциевый залп". Ионы Са 2+ из СР поступают на актин-миозиновый комплекс МФ, открывают активные центры актиновых цепей, вызывая замыкание мостиков и дальнейшее развитие силы и укорочения саркомера;
4 — по окончании процесса сокращения миофибрилл ионы Са 2+ с помощью кальциевых насосов, находящихся в мембране СР, активно заканчиваются внутрь саркоплазматического ретикулума;
5 — процесс электромеханического сопряжения заканчивается тем, что К + пассивно выходит из клетки, вызывая реполяризацию мембраны;
6 — ионы Са 2+ активно выводятся во внеклеточную среду с помощью кальциевых насосов сарколеммы
Таким образом, в кардиомиоците электромеханическое сопряжение идет в две ступени: вначале небольшой входящий поток кальция активирует мембраны СР, способствуя большему выбросу кальция из внутриклеточного депо, а затем в результате этого выброса происходит сокращение саркомера. Описанный выше двухступенчатый процесс сопряжения доказан экспериментально. Опыты показали, что: а) отсутствие потока кальция извне клетки j Ca прекращает сокращение саркомеров, б) в условиях постоянства количества кальция, высвобождаемого из СР, изменение амплитуды потока кальция приводит к хорошо коррелирующему изменению силы сокращения. Поток ионов Са 2+ внутрь клетки выполняет таким образом две функции: формирует длительное (200 мс) плато потенциала действия кардиомиоцита и участвует в процессе электромеханического сопряжения.
Следует отметить, что не во всех мышечных клетках организма процесс сопряжения происходит, как в кардиомиоците. Так, в скелетных мышцах теплокровных потенциал действия короткий (2-3 мс) и медленный поток ионов кальция в них отсутствует. В этих клетках сильно развита Т-система поперечных трубочек, подходящих непосредственно к саркомерам близко к z-дискам. Изменения мембранного потенциала во время деполяризации через Т-систему передается в таких клетках непосредственно на мембрану СР, вызывая залповое высвобождение ионов Са 2+ и дальнейшую активацию сокращения (3, 4, 5).
Общим для любых мышечных клеток является процесс освобождения ионов Са 2+ из внутриклеточных депо — саркоплазматического ретикулума и дальнейшая активация сокращения. Ход кальциевого выброса из СР экспериментально наблюдается с помощью люминесцирующего в присутствии ионов Са 2+ белка экворина, который был выделен из светящихся медуз.
Задержка начала развития сокращения в скелетных мышцах составляет 20 мс, а в сердечной - несколько больше (до 100 мс).
Яд кураре, которым пользуются охотники Амазонки, парализует жертву как раз благодаря тому, что молукулы этого яда, попав в кровь проникают к рецепторам ацетилхолина и усаживаются на них, так что когда к этим рецепторам приходит сам ацетилхолин, свободных мест уже нет, и процесс передачи сигнала на мышечные сокращения преравается. Аналогично работает белок ботулин, вызывающий одно из опаснейших пищевых отравлений, ботулизм. А вот вирус полиомелита разрушает те нервные волокна, по которым с помощью кальция подаются сигналы на мышечные сокращения, и мышцы, оставшись без употребления, постепенно высыхают. С другой стороны, этот же «кальциевый привод» можно использовать в благодетельных целях. Так, сердечыные больные нуждаются в понижении ритма биений сердца, в противном случае оно при нагрузках будет требовать больше кислорода, чем способны дать сузившиеся из-за атеросклероза сосуды. Этим людям помогают «β-блокаторы» – препараты, которые несколько блокируют кальциевые каналы, тем самым понижая уровень кальция и, соответственно, уменьшая размах сокращений сердечной мышцы.
Перемещения внутри обычных клеток осуществляют другие моторы, и в отличие от миозина их изучение началось в 1985 году, когда Том Рииз и Майкл Шитц открыли первый из них – кинезин. Молекула кинезина по своей форме напоминает молекулу миозина – те же округлые головки на длиной ножке. Двумя головками молекула хватается за поверхность микротрубочки, а к торчащей вверх ножке крепится пузырек с химическими веществами. Под воздействием АТФ молекула изгибается, так что ее передняя головка уходит чуть дальше от задней и в результате хватается за микротрубочку чуть дальше по ходу движения; затем задняя головка вновь подтягивается к передней. Затем этот «силовой толчек» повторяется. В итоге пузырек, сидящий на ножке молекулы, рывками движется по микротрубке. Картина напоминает ползущую по ветке гусеницу. Кинезин способен переносить пузырьки с необходимыми клетке химическими веществами только в одном направлении – от центра клетки к ее переферии, а динеин движется в обратном направлении Микротрубки имеют встроеные в них однонаправленные блочные конструкции (с «головой» и «хвостом»). Пока непонятно, как пузырьки узнают, в какую сторону им двигаться. В 1990 году Ричард Велли открыл еще один вид молекулярного мотора — «динамин». В настоящее время считается, что в клетках действует не менее полусотни переносящих или передвигающих груз молекул работающих по отному принципу – преобразование химической энергии в энергию изменения формы гибкой молекулы, которая за счет этого изменения способна «хватать и перехватывать» некое длинное негибкое внутриклеточное волокно и «ползти» по нему с грузом. Кроме того, молекула динеина соединяется с энергетической молекулой АТФ, происходит нечто вроде натягивания лука – центр динеиновой молекулы выходит вперед, а угол между ее концами уменьшается (как сближаются концы лука). Затем, после выполненной работы, молекула динеина как бы «распрямляется» – происходит «силовой толчок» и один конец смещается относительно другого на 15 нм. Такой механизм был расскрыт под руководством С. Берджесса в 2003 году группой ученых



Молекулы осуществляющие функцию движения в нашем теле (а- кинезин, б- динеин, в- миозин). Б) «Молекулярный мотор» кинезина, при помощи которого молекула переносит по микротрубочкам различные вещества.
Потребности работающей мышцы в АТФ удовлетворяются за счет следующих ферментативных реакций:
1. Резерв в виде креатинфосфата. Быстрая регенерация АТФ может быть достигнута за счет переноса фосфатной группы креатинфосфата на АДФ (ADP) в реакции, катализируемой креатинкиназой . Однако и этот мышечный резерв «высокоэргического фосфата» расходуется в течение нескольких секунд. В спокойном состоянии креатинфосфат вновь синтезируется из креатина. При этом фосфатная группа присоединяется по гуанидиновой группе креатина (N-гуанидино-N-метилглицина). Креатин, который синтезируется в печени, поджелудочной железе и почках, в основном накапливается в мышцах. Здесь креатин медленно циклизуется за счет неферментативной реакции с образованием креатинина, который поступает в почки и удаляется из организма.
2 Анаэробный гликолиз. В мышечной ткани наиболее важным долгосрочным энергетическим резервом является гликоген. В покоящейся ткани содержание гликогена составляет до 2% от мышечной массы. При деградации под действием фосфорилазы гликоген легко расщепляется с образованием глюкозо-6-фосфата, который при последующем гликолизе превращается в пируват. При большой потребности в АТФ и недостаточном поступлении кислорода пируват за счет анаэробного гликолиза восстанавливается в молочную кислоту (лактат), которая диффундирует в кровь.
3. Окислительное фосфорилирование. В аэробных условиях образующийся пируват поступает в митохондрии, где подвергается окислению. Окислительное фосфорилирование — наиболее эффективный и постоянно действующий путь синтеза АТФ. Однако этот путь реализуется при условии хорошего снабжения мышц кислородом. Наряду с глюкозой, образующейся при расщеплении мышечного гликогена, для синтеза АТФ используются и другие "энергоносители", присутствующие в крови: глюкоза крови, жирные кислоты и кетоновые тела.
4. Образование инозинмонофосфата [ИМФ (IMP)]. Другим источником быстрого восстановления уровня АТФ является конверсия АДФ в АТФ и АМФ (AMP), катализируемая аденилаткиназой (миокиназой). Образовавшийся АМФ за счет дезаминирования частично превращается в ИМФ (инозинмонофосфат), что сдвигает реакцию в нужном направлении.
Из всех способов синтеза АТФ наиболее продуктивным является окислительное фосфорилирование. За счет этого процесса обеспечиваются потребности в АТФ постоянно работающей сердечной мышцы (миокарда). Вот почему для успешной работы сердечной мышцы обязательным условием является достаточное снабжение кислородом (инфаркт миокарда - это следствие перебоев в поступлении кислорода).
В высокоактивных (красных) скелетных мышцах источником энергии для рефосфорилирования АДФ служит окислительное фосфорилирование в митохондриях. В обеспечении этих мышц кислородом принимает участие миоглобин (Mb) — близкий гемоглобину белок, обладающий свойством запасать кислород. В малоактивных скелетных мышцах, лишенных красного миоглобина и поэтому белых, главным источником энергии для восстановления уровня АТФ является анаэробный гликолиз. Такие мышцы сохраняют способность к быстрым сокращениям, однако они могут работать лишь короткое время, поскольку при гликолизе образование АТФ идет с низким выходом. Спустя некоторое время мышцы истощаются в результате изменения рН в мышечных клетках.
Расщепление гликогена контролируется гормонами. Процесс гликогенолиза стимулируется адреналином (через b-рецепторы) за счет образования цАМФ и активации киназы фосфорилазы. Активация фосфорилазы наступает также при увеличении концентрации ионов Са 2+ во время мышечного сокращения.